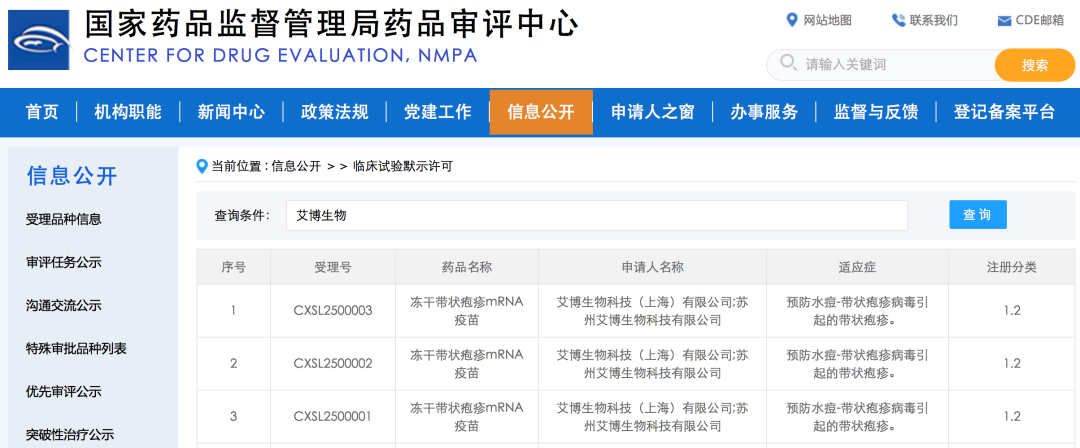
2025年3月28日,据国家药品监督管理局药品审评中心(CDE)官网公示,艾博生物申报的冻干带状疱疹mRNA疫苗新药临床试验(IND)申请(受理号:CXSL2500001,CXSL2500002,CXSL2500003)已获得临床默示许可。这是艾博生物继近期冻干呼吸道合胞病毒mRNA疫苗之后,又一款应用自主知识产权碱基修饰技术和冻干工艺获批临床的产品,再次彰显了艾博生物卓越的创新平台。此外,依托于公司蛋白结构设计平台,该获批疫苗具有独特新颖的抗原设计并具有完全的自主知识产权,在临床前研究中展现出良好的免疫原性、持久性和安全性。
带状疱疹是由水痘-带状疱疹病毒(VZV)再激活引起的感染性皮肤病,主要表现为皮肤损害和神经病理性疼痛,可发生于任何年龄,且发生率随年龄增长显著上升,其中多见于老年人、免疫抑制或免疫缺陷等人群。在我国50岁以上人群中99.5%为VZV携带者。带状疱疹后神经痛(PHN)是带状疱疹最常见的并发症,疼痛剧烈且持续时间长。30%~50%的PHN 患者疼痛时间超过一年,部分可达10 年,严重降低了患者生活质量,极端情况下可能会导致药物依赖、绝望、抑郁甚至自杀。
接种疫苗是预防带状疱疹及PHN的最有效手段。目前,全球上市的带状疱疹疫苗主要包括减毒活疫苗和重组亚单位疫苗两种,而mRNA技术路线的VZV疫苗也在研发中。相较于传统技术路线,mRNA疫苗能够激发高水平的细胞免疫反应,在控制病毒再激活方面具有更强的优势。
近期获批临床的两款采用自有碱基修饰技术的冻干mRNA疫苗,证明了艾博生物拥有行业领先的创新技术平台,具备持续输出优质产品的实力,亦表明在新冠期间经大规模III期临床验证的安全有效的mRNA技术平台,已成功从新冠拓展到RSV、VZV等更多传染病领域。
本次获批的VZV疫苗基于艾博生物蛋白结构设计平台,通过具有完全自主知识产权的突变位点组合,设计出结构更优的gE蛋白作为抗原。抗原蛋白序列确定后,依托公司自有的RNA序列设计平台,通过密码子优化及UTR组合筛选等,进一步获得免疫原性和成药性更优的mRNA序列。临床前数据显示,该疫苗相较于野生型抗原能够诱导更高的免疫原性,可产生高水平的抗体和细胞免疫反应,且免疫持久性突出,同时临床前安全性表现良好。
除此之外,该VZV疫苗采用了艾博生物独创的碱基修饰技术以及国内唯一经大规模III期临床验证且拥有自主知识产权的可电离脂质。该疫苗亦采用了领先的冻干剂型,而非mRNA疫苗常规的液体冷冻剂型,可在2-8℃下长期保存,增加了疫苗的可及性与便利性。
依托卓越的创新技术平台,艾博生物未来将持续输出更多高质量产品,在传染病、肿瘤免疫、蛋白替代等领域有更多突破性的进展。





